
- Yazar Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:41.
- Son düzenleme 2025-06-01 05:06.
lewis yapılar (olarak da bilinir) Lewis noktası yapılar veya elektron noktası yapılar) vardır diyagramlar bir molekül içindeki atomların değerlik elektronlarını temsil eder. Bunlar lewis semboller ve lewis yapılar, atomların ve moleküllerin değerlik elektronlarını, ister yalnız çiftler olarak ister bağlar içinde bulunsunlar görselleştirmeye yardımcı olur.
Bununla ilgili olarak, bir anyon için Lewis nokta diyagramını nasıl tanımlarsınız?
Lewis elektron nokta diyagramları kullanmak noktalar bir atom sembolü etrafındaki değerlik elektronlarını temsil etmek için. Lewis elektron nokta diyagramları iyonlar için daha az (katyonlar için) veya daha fazla (için anyonlar ) noktalar karşılık gelen atomdan daha
Ek olarak, polarite nasıl tanımlanır? Kimyada, polarite atomların birbirine bağlanma şeklini ifade eder. Atomlar kimyasal bağda bir araya geldiklerinde elektronları paylaşırlar. A kutupsal molekül, atomlardan biri bağdaki elektronlar üzerinde daha güçlü bir çekici kuvvet uyguladığında ortaya çıkar.
Bunun için nokta diyagramını ne için kullanıyorsunuz?
Orası NS atomların nasıl kovalent veya iyonik bağlar oluşturduğunu göstermenin kestirme yolları. lewis nokta diyagramları noktaları kullanır bir atomun en dış enerji seviyesindeki elektronları temsil etmek için atom sembolü etrafında düzenlenmiştir. Tek bağlar NS bir çift ile temsil edilir noktalar veya atomlar arasında bir çizgi.
Resmi ücreti nasıl buluyorsunuz?
Resmi Ücret = [# nötr atomdaki değerlik elektronları] - [(# yalnız elektron çiftleri) + (½ # bağ elektronları)] Değerlik elektronları = periyodik tablonun grup numarasına karşılık gelir (temsili elementler için). Yalnız Çiftler = atom üzerinde oturan yalnız elektronlar. Her elektron bir olarak sayılır ve bu nedenle bir çift iki olarak sayılır.
Önerilen:
Tür terimi genel olarak nasıl tanımlanır?

Tür terimi genel olarak nasıl tanımlanır? Çiftleşebilen ve her iki cinsiyetten verimli yavrular üretebilen bir grup organizma
İki nokta verilen nokta eğimi biçiminde bir denklemi nasıl yazarsınız?

Bir doğrunun denklemini yazabileceğimiz çeşitli formlar vardır: nokta-eğim formu, eğim-kesişim formu, standart form vb. İki nokta (x1, y1) ve (x2, y2) verilen bir doğrunun denklemi ) doğrunun içinden geçtiği, ((y - y1)/(x - x1)) / ((y2 - y1)/(x2 - x1)) ile verilir
Genel olarak işlevsel bir grup nedir ve bu tür gruplar neden bu kadar önemlidir?

Fonksiyonel gruplar, organik moleküllerin karbon omurgasına bağlıdır. Moleküllerin özelliklerini ve kimyasal reaktivitesini belirlerler. Fonksiyonel gruplar, karbon omurgasından çok daha az kararlıdır ve kimyasal reaksiyonlara katılması muhtemeldir
Lensler için ışın diyagramını nasıl kullanıyorsunuz?
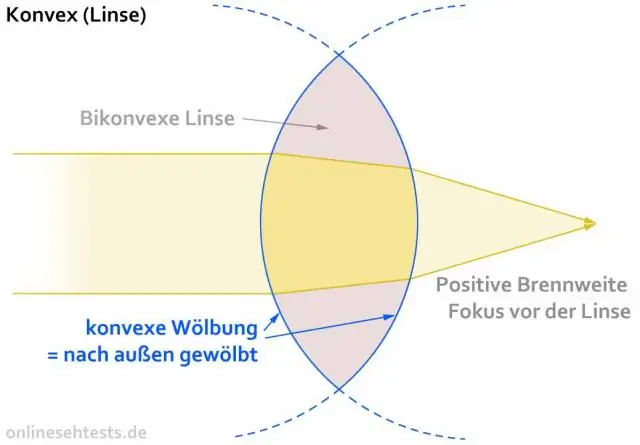
Nesnenin üstünde bir nokta seçin ve merceğe doğru giden üç olay ışını çizin. Düz bir kenar kullanarak, merceğe giden yolda tam olarak odak noktasından geçecek şekilde bir ışını doğru bir şekilde çizin. İkinci ışını asal eksene tam paralel olacak şekilde çizin
Genel olarak ses nasıl üretilir?

Bir şey titreştiğinde ses üretilir. Titreşen cisim ortama (su, hava vb.) neden olur. Havadaki titreşimlere duyabildiğimiz uzunlamasına hareket eden dalgalar denir. Ses dalgaları, sırasıyla sıkıştırma ve seyrekleşme olarak adlandırılan yüksek ve alçak basınç alanlarından oluşur
