
- Yazar Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:41.
- Son düzenleme 2025-01-22 17:12.
Nedir pH bir hidrojenyon konsantrasyonu ile çözelti 10^-6M? pH H+'nın bir ölçüsüdür iyon konsantrasyonu → H+ ne kadar yüksekse iyon konsantrasyonu , daha düşük pH (yani 0'a daha yakın) ve daha asidik çözüm . Bu nedenle pH arasında çözüm 6'dır, yani zayıf asidiktir.
Bu bağlamda, pH'lı bir çözeltinin hidrojen iyonu konsantrasyonu nedir?
Böylece, pH Tarafından belirlenir hidrojen - iyon konsantrasyonu . tarafsız olması durumunda çözüm , [H+]=10-7, dediğimiz pH of 7. Bu, örneğin, bir hidrojen - bir çözeltinin iyon konsantrasyonu Birlikte pH 4'ün 10'u-4mol/l, yani 0.0001 mol içerir hidrojen iyonları içinde çözüm 1 litre.
Aynı şekilde, sulu bir çözeltinin pH'ı nedir? NS sulu bir çözeltinin pH'ı dayanmaktadır pH tipik olarak suda 0 ila 14 arasında değişen ölçek (aşağıda tartışıldığı gibi bu resmi bir kural olmamasına rağmen). A pH 7'nin nötr olduğu kabul edilir. A pH 7'den az asitli olarak kabul edilir. A pH 7'den büyük olması temel olarak kabul edilir.
Ayrıca, hidrojen iyonu konsantrasyonu nedir?
Tanımı hidrojen - iyon konsantrasyonu : NS konsantrasyon ile ilgili hidrojen iyonları genellikle litre başına mol veya pH birimleri olarak ifade edilen ve çözelti indikatör boyalarının dar aralıklarında asitliğinin bir ölçüsü olarak kullanılan çözeltide hidrojen - iyon konsantrasyonu.
pH konsantrasyona bağlı mıdır?
HİDROJEN İYON KONSANTRASYON VE pH pH bu nedenle hidrojen iyonunun tersinin 10 tabanına göre logaritması olarak tanımlanır konsantrasyon veya hidrojen iyonunun 10 tabanına göre logaritmanın negatif değeri konsantrasyon . Bu nedenle şu sonuç çıkar: Anötral solüsyonun bir pH 7.0.
Önerilen:
Suda fazla hidrojen iyonu üreten bileşik nedir?

Asit. Suda fazla hidrojen iyonu üreten bir bileşik
A ve B kan grubuna sahip ebeveynler O'lu bir çocuğa sahip olabilir mi?
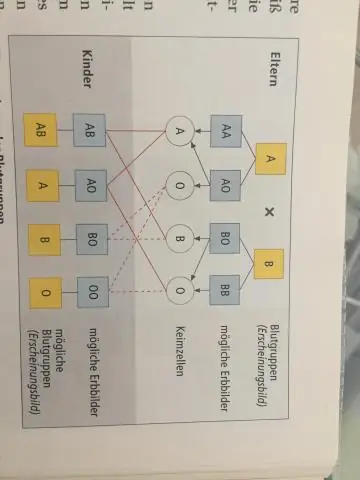
Evet, çünkü her insanın kan grubu için iki 'geni' vardır. Bu nedenle, A veya B kan grubuna sahip iki ebeveyn, O kan grubuna sahip bir çocuk üretebilir. Her ikisinde de AO veya BO genleri varsa, her ebeveyn, yavruya bir O geni bağışlayabilir. Yavrular daha sonra OO genlerine sahip olacak ve onları kan grubu O yapacak
Isıtıldığında bir çözeltinin konsantrasyonuna ne olur?

Bir çözeltinin sıcaklığı arttığında doyma konsantrasyonuna ne olur? Çözelti ısıtıldığında ne olur? Bir maddeyi ne kadar çok ısıtırsanız, o kadar çok şeker çözülürse, maddenin doyması için daha fazla zaman alacağından, ısıtıldığında çözünürlük daha yüksek olacaktır. Ayrıca donma
Sulu kurşun II nitratın sulu sodyum bromür ile reaksiyonu için net iyonik denklem nedir?

Sulu sodyum bromür ve sulu kurşun(II) nitratın reaksiyonu, dengeli net iyonik denklem ile temsil edilir. 2Br−(sulu)+Pb2+(sulu)→PbBr2(s) 2 B r − (a q) + P b 2 + (a q) → P b B r 2 (s)
Bir litre suda kaç tane serbest hidrojen iyonu vardır?

Kartlar Terim Bir asit reaksiyona girdiğinde hangi bileşikler oluşur? Tuz ve su tanımı Terim Bir litre suda kaç tane serbest hidrojen iyonu vardır? Tanım yok; hepsi hidratlıdır Terim Nötr bir çözeltideki hidronyum iyonlarının konsantrasyonu nedir? Tanım 10^-7 M
